UNIST 권혁무 교수팀, 루푸스 발병 관련 톤이비피 단백질 작동 원리 규명
루푸스 치료제 개발을 위한 단서 제시… Kidney International 게재
 |
| 권혁무 교수 |
루푸스(전신 홍반 루푸스)는 정확한 원인이나 예후 예측이 힘든 난치성 자가면역질환이며, 우리 몸의 면역체계 이상으로 인해 피부 뿐만 아니라 다양한 장기에 염증을 일으켜 천의 얼굴을 가진 질환으로 불린다. 대표적으로 관절염, 신장이나 심장 손상이 발생할 수 있고, 특히 신장 염증에 의해 신장 기능이 소실되면 투석 치료를 받거나 신장 이식수술을 필요로 할 수 있으며 이는 사망 위험성을 높이는 주요한 요인 중 하나다.
최근 한 단백질이 루푸스와 신장염 발생을 촉진한다는 사실이 밝혀졌다. 루푸스 발병의 원인과 새로운 치료제 개발을 위한 단서를 제시할 것으로 기대된다.
UNIST(울산과학기술원) 생명과학과 권혁무 교수팀은 연세대학교 신장내과 양재석 교수팀과 함께 ‘톤이비피(TonEBP)’라는 단백질이 루푸스와 신장염 발생을 촉진한다는 사실을 밝혔다.
이번 연구에서 루푸스 신장염 환자의 신장에서 대조군 환자보다 톤이비피가 더 많이 발현되는 것이 확인됐다. 이는 신장 내 세포뿐만 아니라 대식세포, T세포와 같은 면역 기능 유지에 중요한 세포에서도 같은 경향을 보였다. 이렇게 증가된 톤이비피는 세균이나 바이러스 감염 등 염증반응에 깊이 관여하는 염증성 사이토카인과 높은 상관관계를 보였다.
함께 진행된 동물실험에서는 톤이비피 단백질을 조절해 루푸스 발병과 신장 손상을 억제할 수 있다는 사실도 밝혔다. 연구팀은 골수성 세포에서만 특이적으로 톤이비피를 줄인 동물실험에서 루푸스 발병과 신장 손상을 억제할 수 있다는 사실을 확인했다. 이는 톤이비피가 대식세포에서 식세포작용과 항원 전달을 통해 T세포의 분화를 조절하기 때문이다.
또한 연구팀은 대식세포에서 사멸됐거나 손상된 세포에서 발현되는 손상연관분자패턴에 의해 톤이비피 발현이 증가한다는 것을 확인했다. 이는 식세포작용을 막아, 사이토카인 생성에 관여하는 엔에프-카파비와 인터페론조절인자를 제어해 다양한 염증성 사이토카인을 발현시킬 수 있다. 즉, 톤이비피를 줄이면 이러한 염증반응이 줄어들어 루푸스 발병과 신장 손상을 막을 수 있는 것이다.
권혁무 생명과학과 교수는 “이번 연구를 통해 톤이비피가 루푸스 발병 요인임을 확인했다”며 “이번 연구를 통해 발병의 원인을 파악하고 더 나아가 새로운 치료제 개발을 위한 단서를 제시했다”고 전했다.
이번 연구는 신장병 관련 최상위 국제 학술지 Kidney International에 5월 5일자로 온라인 공개됐으며 7월 1일 출판됐다. 연구 수행은 과학기술정보통신부 한국연구재단의 중견과제와 선도연구센터(SRC) 지원사업으로 이뤄졌다.
논문명: Macrophage transcription factor TonEBP promotes systemic lupus erythematosus and kidney injury via damage-induced signaling pathways
 |
| 루푸스 신염 환자 신장조직 내 세포에서의 톤이비피 발현 |
 |
| 루푸스 신염 환자 신장조직 내 톤이비피와 전염증성 사이토카인의 상관관계 |
□연구개요
1. 연구배경
최근 5년간 국내 루푸스 환자는 증가 추세에 있음에도 (2015년 20,902명 → 2019년 26,556명) 근본적인 치료제가 부족하여 새로운 치료제에 대한 미충족 수요가 높다. 또한 루푸스 치료제 시장 규모는 2017년 기준 2조 원 (19억 달러)로 추정되고, 2025년까지 시장의 연평균 성장률이 7% 상승하여 2025년까지 3조 원 이상 (30억 달러)에 이를 것으로 전망하고 있다. 신약 개발 시에 큰 경제적 이득이 발생할 수 있을 것으로 보인다.
톤이비피는 고장성 환경에서 삼투조절물질들의 발현을 조절하여 신장세포의 생존에 중요한 역할을 하는 전사인자로써 본 연구자에 의해 1999년 처음 발견되었다.
최근 연구에 따르면 톤이비피는 면역대사 스트레스에 깊이 관여하고 있으며 간암, 당뇨병성 신증, 류마티스 관절염, 뇌염증과 같은 다양한 염증성 질환을 촉진하는 역할을 하고 있다.
대식세포에서 톤이비피는 여러 가지 염증 신호에 의해서 발현이 증가되고, 이는 전염증성 대식세포(M1)로의 분극화를 촉진하고, 항염증성 대식세포(M2)로의 분극화를 억제하는 것으로 알려져 있다.
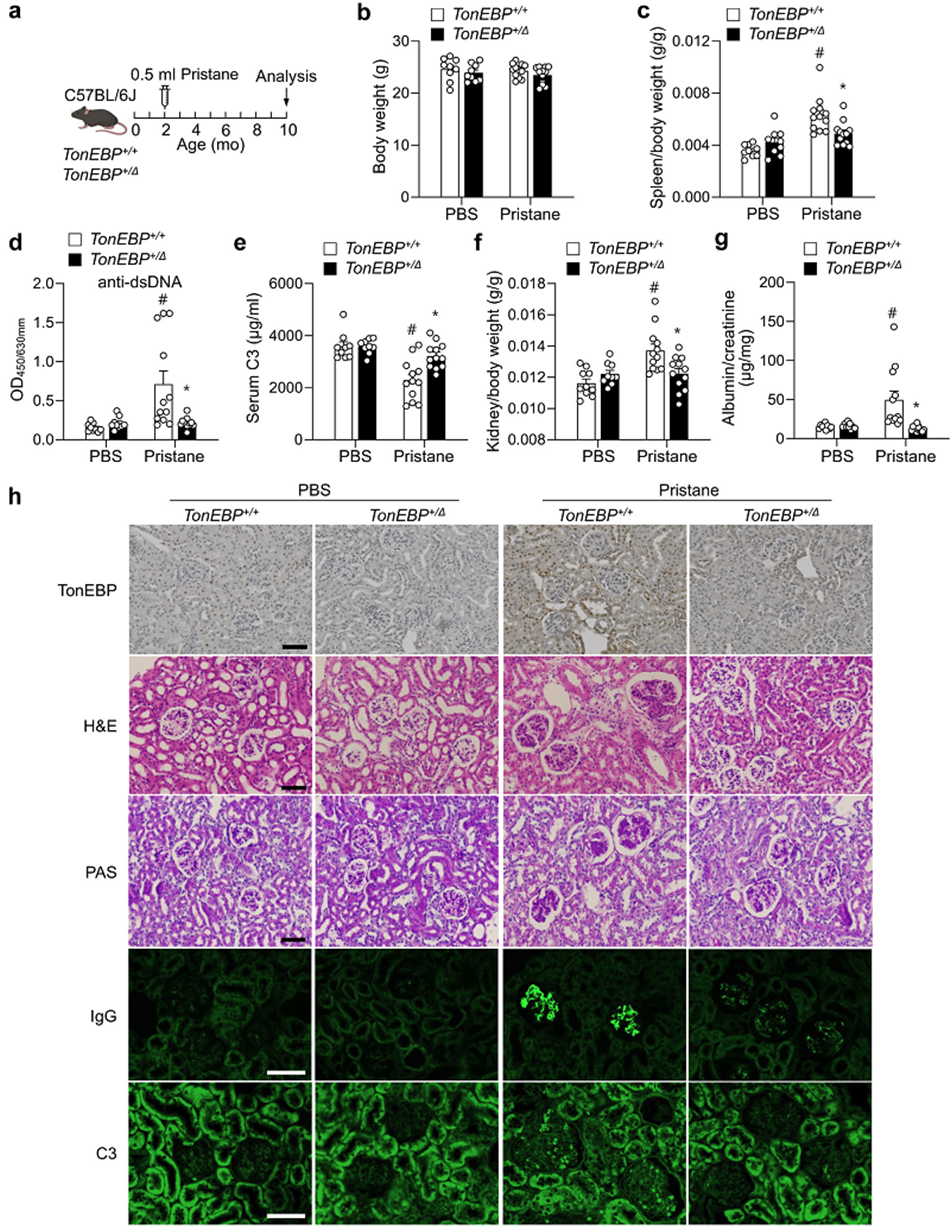 |
| 톤이비피를 줄인 쥐에서 루푸스 및 신장 손상 억제 확인 |
 |
| 톤이비피를 줄인 쥐에서 루푸스 및 신장 손상 억제 확인 |
2. 연구내용
루푸스 신염 환자의 신장조직 내 톤이비피 발현이 대조군 환자보다 증가되어있으며, 신장 내 톤이비피 발현 분포를 보았을 때 신장세포뿐만 아니라 면역세포(T세포와 대식세포)에서 톤이비피 발현이 높은 것을 확인했다. 루푸스 신염 환자의 신장 내 높은 톤이비피 발현은 다양한 전염증성 사이토카인 발현과 상관관계를 보였다.
동물실험을 통해 톤이비피 단백질이 부족한 쥐에서 루푸스 발병과 신장 손상이 억제됨을 밝혔다. 또한 골수성세포에서만 특이적으로 톤이비피 없는 쥐에서도 루푸스 발병과 신장 손상이 억제됨을 확인하였다. 대식세포 특이적으로 톤이비피가 없는 쥐에서 대식세포와 호중구 수가 감소되어 있고, CD4 양성 보조 T세포에서 Th1세포와 Th17세포로의 분화가 억제됐다.
대식세포에 손상연관분자패턴을 처리하여 톨유사수용체를 활성화시키면 톤이비피의 발현이 증가하고, 증가된 톤이비피는 식세포작용을 억제하고 사이토카인 전사인자들인 엔에프-카파비와 인터페론조절인자의 활성조절을 통해 전염증성 사이토카인들의 생성 및 항원제시를 촉진하여 T세포의 분화에 영향을 주는 것으로 확인했다.
3. 기대효과
현재 루푸스 환자의 수는 증가하고 있음에도 불구하고 루푸스의 정확한 발병 기전 부재와 예후 예측이 힘든 점을 극복하고, 루푸스 및 신장 손상을 유발하는 원인 유전인자를 밝힘으로써 예방 및 치료를 극대화 할 수 있을 것이라는 기대효과가 있다.
새로운 루푸스 발병제어 치료 타겟을 제안하여 커져가는 루푸스 치료제 시장에 뛰어들 수 있는 근본적인 치료제 개발의 실마리를 제공할 것으로 사료된다.
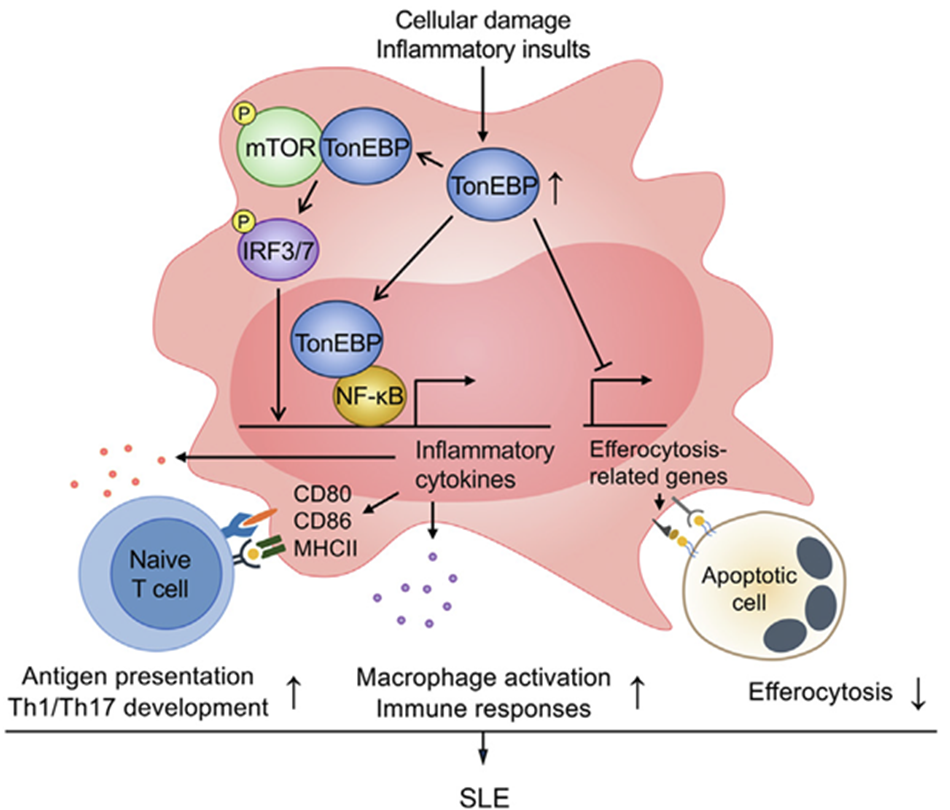 |
| 대식세포 내 톤이비피에 의한 루푸스 발병 작용 기작 |
□용 어 설 명
1. 톤이비피 (TonEBP)
처음에는 고장성 환경에서 삼투조절물질들의 발현을 조절하여 신장세포의 생존에 중요한 역할을 하는 전사인자로 발견되었으나, 최근 연구에서 면역대사 스트레스에 깊이 관여하고 있으며 다양한 염증성 질환을 촉진하는 역할을 하고 있다.
2. 사이토카인 (cytokines)
면역세포로부터 분비되는 면역 조절 인자로서 특정 수용체를 통하여 면역 반응에 관여한다. 케모카인, 인터페론, 인터루킨 및 종양괴사인자 등이 포함된다.
3. 손상연관분자패턴 (damage-associated molecular patterns)
우리 몸 안 세포에 생물화학적인 요인이나 물리적 외상 등으로 인해 손상이 발생하였을 때, 세포 내부의 물질이 세포 밖으로 나가게 됨에 따라 톨유사수용체에 의해 인식되어 비병원체성 염증반응을 통해 제거하게 되는 것이다.
4. 톨유사수용체 (toll-like receptor, TLR)
미생물 유래의 병원체 관련 분자패턴 (pathogen-associated molecular patterns)과 숙주 유래의 손상연관분자패턴 (damage-associated molecular patterns)을 인식하여 면역반응을 가동시키는 수용체이다. 하지만 톨유사수용체가 과발현하면 면역반응이 과도하게 증가해 오히려 자기 몸을 공격하는 자가면역질환을 유발할 수 있다.
5. 엔에프-카파비 (nuclear factor-kappa B, NF-kB)
사이토카인 생성에 관여하는 단백질로, 염증 반응에 핵심적인 역할을 하는 것으로 알려져있다.
6. 인터페론조절인자 (interferon regulatory factor, IRF)
인터페론 및 인터페론으로 유도되는 유전자의 발현에 관여하는 전사인자이다.
UNIST 홍보실 제공
노벨사이언스 science@nobelscience.co.kr
<저작권자 © 노벨사이언스, 무단 전재 및 재배포 금지>



 간단한 공정으로 이산화탄소 분리 성공
간단한 공정으로 이산화탄소 분리 성공








